Parkinsonin tautia sairastaa 1–2 % yli 65-vuotiaasta väestöstä (11 de Lau LM, Breteler MM. Epidemiology of Parkinson's disease. Lancet Neurol 2006;5:525–35.). Sen keskeiset patologiset piirteet ovat hermosolujen proteiini-inkluusiot, Lewyn kappaleet ja neuriitit, jotka koostuvat pääosin alfasynukleiinin liukenemattomista amyloidifibrilleistä (22 Spillantini MG, Schmidt ML, Lee VM, Trojanowski JQ, Jakes R, Goedert M. Alpha-synuclein in Lewy bodies. Nature 1997;388:839–40.). Diagnoosi on kliininen ja perustuu tyypillisten motoristen oireiden (bradykinesia, rigiditeetti ja lepovapina) toteamiseen.
Taustalla on aivojen tyvitumakkeiden dopaminergisen säätelyn häiriö, joka johtuu mustatumakkeen (substantia nigra) vauriosta (33 Fearnley JM, Lees AJ. Ageing and Parkinson's disease: substantia nigra regional selectivity. Brain 1991;114:2283–301.). Dopaminergisillä soluilla on erityisiä alfasynukleiinipatologialle altistavia ominaisuuksia, ja yleisesti neuronit, joilla on voimakkaasti haaroittuneet ja heikosti myelinoidut aksonit, ovat muita hermoja alttiimpia (44 Surmeier DJ. Determinants of dopaminergic neuron loss in Parkinson's disease. FEBS J 2018;285:3657–68.).
Lewyn patologian kaavamaista leviämistä keskushermostossa kuvaamaan on kehitetty erilaisia malleja, joista tunnetuin on Braakin malli (55 Braak H, Del Tredici K, Rub U, de Vos RA, Jansen Steur EN, Braak E. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiol Aging 2003;24:197–211.). Sen mukaan patologia leviää hajukäämistä ja aivorungosta kohti keskiaivoja ja lopulta kohti kortikaalisia rakenteita. Motoriset oireet ilmaantuvat, kun 60–80 % mustatumakkeen neuroneista on tuhoutunut. Siinä vaiheessa Lewyn patologiaa todetaan monien aivorungon monoaminergisten tumakkeiden ohella usein myös vagushermon motorisessa ja hajuhermon anteriorisessa tumakkeessa (55 Braak H, Del Tredici K, Rub U, de Vos RA, Jansen Steur EN, Braak E. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiol Aging 2003;24:197–211.).
Parkinsonin tauti on monielinsairaus, johon liittyy moninaisia ei-motorisia oireita.
Lewyn patologia ei rajoitu keskushermostoon, vaan sitä todetaan laaja-alaisesti myös autonomisesta hermostosta ja ruoansulatuskanavan hermojärjestelmästä, enteerisestä hermostosta. Parkinsonin tauti onkin monielinsairaus, johon liittyy moninaisia ei-motorisia oireita, kuten neuropsykiatrisia, uni- ja vireystilan sekä autonomisen hermoston toiminnan häiriöitä. Osa näistä ilmaantuu ennen motorisia oireita, mikä herättää pohdintaa taudin patogeneesin alkulähteestä. Vahvin taudin myöhempää puhkeamista ennustava tekijä on vilkeunen aikainen käytöshäiriö (RBD), jonka ajatellaan liittyvän vilkeunen syntymiseen vaikuttavien aivorungon tumakkeiden vaurioon (66 Ylikoski A, Partinen M. Behavioraalinen unioireyhtymä eli RBD. Duodecim 2012;128:1602–6.).
Ruoansulatuskanavan oireet, kuten ummetus ja ulostamisvaikeudet kuuluvat ei-motorisista oireista yleisimpiin (taulukko 1).

Ummetusta on varhaisimpana premotorisena oireena todettu jopa 10–20 vuotta ennen motoristen oireiden puhkeamista (77 Savica R, Carlin JM, Grossardt BR ym. Medical records documentation of constipation preceding Parkinson disease: A case-control study. Neurology 2009;73:1752–8.). Alfasynukleiinipatologiaa on todettu suolistossa vuosia ennen motoristen oireiden ilmaantumista. Parkinson-potilailla on todettu myös suoliston parasympaattisen hermoston vauriota, vaikkakin niiden korrelaatio subjektiivisten suolisto-oireiden kanssa on ollut tutkimuksissa heikkoa (88 Borghammer P, Knudsen K, Brooks DJ. Imaging systemic dysfunction in Parkinson's disease. Curr Neurol Neurosci Rep 2016;16:51.).
Varhaiset suolisto-oireet sekä vagushermon motorisen tumakkeen varhainen affisio ovat synnyttäneet hypoteesin, jonka mukaan Parkinsonin tauti voisi saada alkunsa maha-suolikanavasta kehon ulkopuolelta tulevan patogeenin tai toksiinin seurauksena ja levitä sieltä keskushermostoon vagushermoa pitkin (99 Braak H, Rub U, Gai WP, Del Tredici K. Idiopathic Parkinson's disease: possible routes by which vulnerable neuronal types may be subject to neuroinvasion by an unknown pathogen. J Neural Transm (Vienna) 2003;110:517–36.).
Nykyään ajatellaan, että vagushermon ohella mikrobisto-suoli-aivoakselilla voisi olla laajempaakin merkitystä taudin patogeneesin ja oireiden taustalla (kuvio 1suolistomikrobi-AdobeStock_339315983. ). Termi viittaa aivojen ja suoliston mikrobiston kaksisuuntaiseen vuorovaikutukseen hermo- ja immuunivälitteisten, endokriinisten sekä metabolisten reittien välityksellä. Akselilla on merkittävä rooli kehon homeostaasin säätelyssä, ja se on liitetty monien sairauksien, kuten lihavuuden, mielialahäiriöiden ja autismin syntyyn (1010 Lynch SV, Pedersen O. The human intestinal microbiome in health and Disease. N Engl J Med 2016;375:2369–79.).
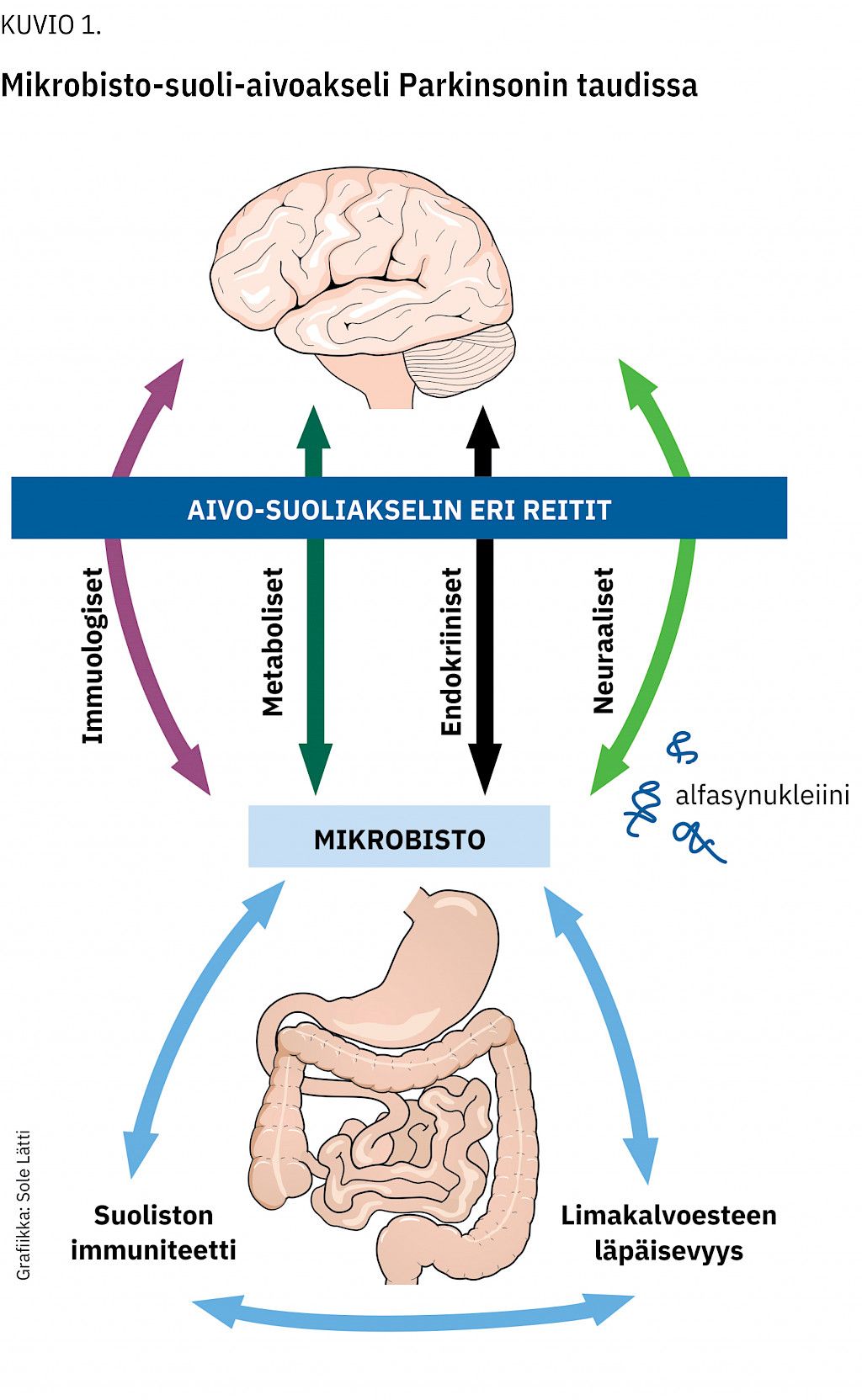
Taustalla alfasynukleiinipatologia
Parkinsonin taudin taustalla ajatellaan olevan perimän, ympäristötekijöiden ja ikääntymisen yhteisvaikutus (1111 Chen H, Wang K, Scheperjans F, Killinger B. Environmental triggers of Parkinson's disease - Implications of the Braak and dual-hit hypotheses. Neurobiol Dis 2022;163:105601.). Ympäristömyrkyt, kuten torjunta-aineet, vaikuttavat lisäävän ja kahvi sekä tupakka puolestaan pienentävän riskiä, joskin tupakan osalta havaittu yhteys saattaa selittyä taustatekijöillä (1212 Bloem BR, Okun MS, Klein C. Parkinson's disease. Lancet 2021;397:2284–303.).
Monogeenisten mutaatioiden arvioidaan selittävän 3–5 % tapauksista. Monet näistä geeneistä liittyvät alfasynukleiinin aggregaation ja neurodegeneraation taustalla oleviin mekanismeihin, kuten mitokondrioiden toimintahäiriöön, oksidatiiviseen stressiin ja neuroinflammaatioon (1313 Deng H, Wang P, Jankovic J. The genetics of Parkinson disease. Ageing Res Rev 2018;42:72–85.) (kuvio 237-38 tiede KA Meretsalmi_taul1. ).
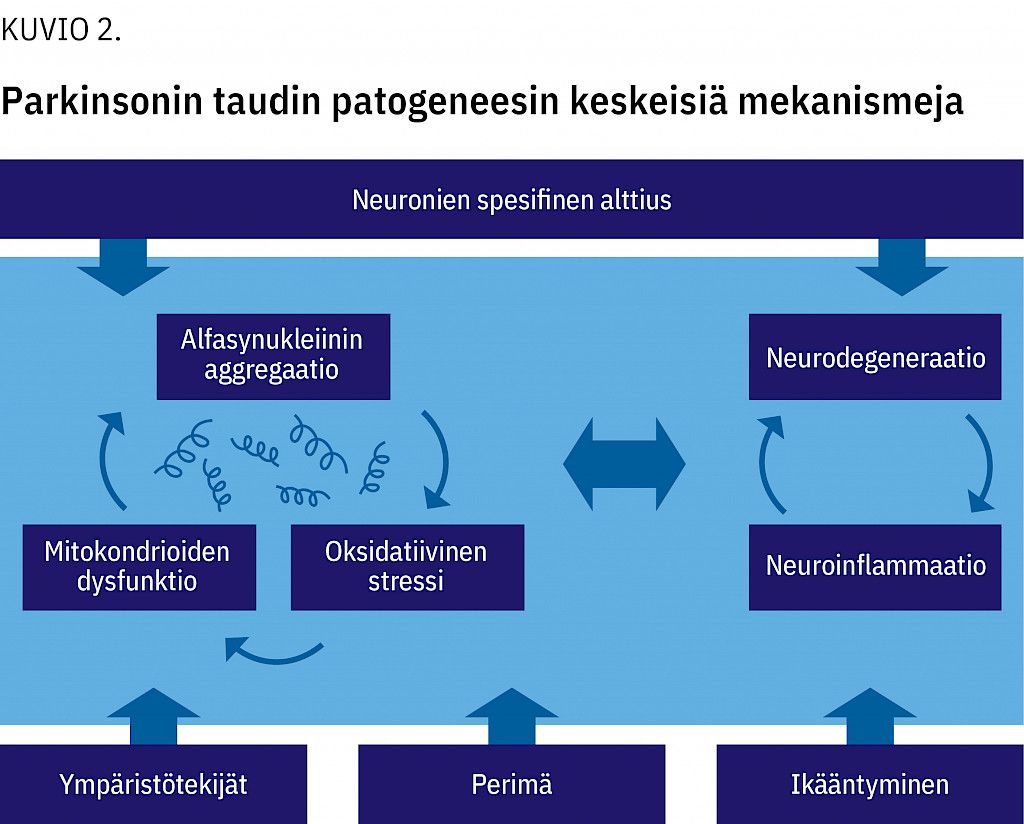
Alfasynukleiinin virheelliseen laskostumiseen ja aggregaatioon vaikuttavat mm. solunsisäiset olosuhteet ja proteolyyttisten järjestelmien toiminta (1414 Rocha EM, De Miranda B, Sanders LH. Alpha-synuclein: Pathology, mitochondrial dysfunction and neuroinflammation in Parkinson's disease. Neurobiol Dis 2018;109:249–57.). Myös alfasynukleiinin aggregaation välivaiheilla, oligomeereillä, voi olla merkitystä patogeneesissä (1515 Winner B, Jappelli R, Maji SK ym. In vivo demonstration that alpha-synuclein oligomers are toxic. Proc Natl Acad Sci U S A 2011;108:4194–9.). Niiden ajatellaan altistavan solutuholle häiritsemällä mm. mitokondrioiden toimintaa ja lisäämällä oksidatiivista stressiä. Tästä voi seurata noidankehä: solutuho aktivoi keskushermoston immuunijärjestelmää, ja tästä seuraava inflammaatio ja oksidatiivinen stressi voivat entisestään altistaa alfasynukleiinin aggregaatiolle ja solutuholle (1616 Gelders G, Baekelandt V, Van der Perren A. Linking neuroinflammation and neurodegeneration in Parkinson's disease. J Immunol Res 2018;2018:4784268.).
Parkinsonin tautin ns. suolistohypoteesi perustuu Braakin mallin mukaiseen hajukäämin ja vagushermon motorisen tumakkeen vaurioitumiseen ensimmäisten keskushermoston rakenteiden joukossa (99 Braak H, Rub U, Gai WP, Del Tredici K. Idiopathic Parkinson's disease: possible routes by which vulnerable neuronal types may be subject to neuroinvasion by an unknown pathogen. J Neural Transm (Vienna) 2003;110:517–36.). Teoria on edelleen kiistelty mm. siksi, että Lewyn patologian eteneminen keskushermostossa ei noudata kaikilla potilailla Braakin mallia (1717 Jellinger KA. Is Braak staging valid for all types of Parkinson's disease? J Neural Transm (Vienna) 2019;126:423–31.). Taudin ilmiasu on varsin vaihteleva ja osittain päällekkäinen muiden hermorappeumasairauksien kanssa. Osalla potilaista todetaan samanaikaisesti esimerkiksi Alzheimerin taudille tyypillisiä patologisia löydöksiä, ja sekamuotoisella patologialla on oma vaikutuksensa taudin ilmiasuun (1818 Walker L, Stefanis L, Attems J. Clinical and neuropathological differences between Parkinson's disease, Parkinson's disease dementia and dementia with Lewy bodies - current issues and future directions. J Neurochem 2019;150:467–74.).
Onkin epätodennäköistä, että suolisto tai muukaan yksittäinen tekijä olisi Parkinsonin taudin taustalla kaikissa tapauksissa. Kuitenkin lisääntyvä tutkimusnäyttö viittaa siihen, että suolisto voi olla patogeneesin lähtökohta osalla potilaista (1919 Shannon KM, Vanden Berghe P. The enteric nervous system in PD: gateway, bystander victim, or source of solutions. Cell Tissue Res 2018;373:313–26.). Alfasynukleiinin alkuperä ja konnektomi -mallin (The alpha-Synuclein Origin and Connectome, SOC Model) mukaisesti potilaat voitaisiin jakaa alfasynukleiinipatologian alkulähteen perusteella alaryhmiin ”brain-first” ja ”body-first” (2020 Borghammer P. The alpha-Synuclein Origin and Connectome Model (SOC Model) of Parkinson's disease: explaining motor asymmetry, non-motor phenotypes, and cognitive decline. J Parkinsons Dis 2021;11:455–74.). On esitetty, että erityisesti vilkeunen aikaisesta käytöshäiriöstä kärsivät potilaat, joille myöhemmin kehittyy Parkinsonin tauti, voisivat edustaa body-first-alaryhmää (2020 Borghammer P. The alpha-Synuclein Origin and Connectome Model (SOC Model) of Parkinson's disease: explaining motor asymmetry, non-motor phenotypes, and cognitive decline. J Parkinsons Dis 2021;11:455–74.).
Mahdollisia mekanismeja
Helikobakteeri- ja muut suolistoinfektiot, tulehdukselliset suolistosairaudet ja ärtyvän suolen oireyhtymä on liitetty Parkinsonin taudin lisääntyneeseen riskiin, vaikkakin tulokset ovat olleet osittain ristiriitaisia (2121 Li Y, Chen Y, Jiang L ym. Intestinal inflammation and Parkinson's disease. Aging Dis 2021;12:2052–68.). Patogeenit ja toksiinit voivat lisätä alfasynukleiinin aggregaatiotaipumusta esimerkiksi tulehdusreaktiosta seuraavan oksidatiivisen stressin välityksellä (2222 Kelly LP, Carvey PM, Keshavarzian A ym. Progression of intestinal permeability changes and alpha-synuclein expression in a mouse model of Parkinson's disease. Mov Disord 2014;29:999–1009.). Suoliston inflammaatio voi lisätä alfasynukleiinin ekspressiota ja tietyt mikrobiperäiset amyloidiproteiinit voivat myös toimia ns. siemenenä (seed) alfasynukleiinin aggregaatiolle ns. molekyylijäljittelyn (molecular mimicry) kautta (2323 Stolzenberg E, Berry D, Yang D ym. A role for neuronal alpha-synuclein in gastrointestinal immunity. J Innate Immun 2017;9:456–63.,2424 Miraglia F, Colla E. Microbiome, Parkinson's disease and molecular mimicry. Cells 2019;8(3).). Alfasynukleiinilla on prionin kaltaisia ominaisuuksia, minkä vuoksi aggregaatit voivat siirtyä neuronista toiseen ja toimia siemenenä alfasynukleiinin virheelliselle laskostumiselle. Tämä on osoitettu eläinkokeissa (2525 Holmqvist S, Chutna O, Bousset L ym. Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats. Acta Neuropathol 2014;128:805–20.).
Vagushermon voimakkaasti haaroittuneet aksonit ovat suoraan tai välineuronien välityksellä vuorovaikutuksessa suoliston limakalvon kanssa altistaen ne suoliston patogeenien ja toksiinien vaikutuksille. Vagotomian on todettu olevan yhteydessä pienentyneeseen Parkinsonin taudin riskiin (2626 Svensson E, Horvath-Puho E, Thomsen RW ym. Vagotomy and subsequent risk of Parkinson's disease. Ann Neurol 2015;78:522–9.), mutta alfasynukleiinipatologian prionin kaltainen leviäminen vagushermoa pitkin ihmisillä on edelleen kiistanalaista (2727 Surmeier DJ, Obeso JA, Halliday GM. Parkinson's disease is not simply a prion disorder. J Neurosci 2017;37:9799–807.). Suoliston olosuhteet voivat kuitenkin vaikuttaa taudin patogeneesiin mikrobisto-suoli-aivoakselin kautta muillakin mekanismeilla.
Suoliston mikrobisto koostuu sadoista mikrobilajeista, jotka yhdessä käsittävät miljoonia geenejä. Se osallistuu suoli-aivoakselin välityksellä elimistön homeostaasin säätelyyn: monimuotoinen mikrobisto on yhteydessä hyvään terveyteen, ja toisaalta sen koostumuksen muutoksilla on todettu olevan yhteyttä useiden sairauksien syntyyn (1010 Lynch SV, Pedersen O. The human intestinal microbiome in health and Disease. N Engl J Med 2016;375:2369–79.). Suoliston immuunijärjestelmä on tiiviissä vuorovaikutuksessa mikrobiston kanssa. Keskeisenä tekijänä tässä säätelyssä toimii limakalvoeste, joka yhdessä suoliston muiden fysiologisten ominaisuuksien kanssa määrittää suoliston vallitsevat olosuhteet (2828 Mowat AM, Agace WW. Regional specialization within the intestinal immune system. Nat Rev Immunol 2014;14:667–85.).
Ikääntymisen ja sairauksien aiheuttamat fysiologiset muutokset sekä ulkoiset tekijät (ruokavalio, lääkkeet, taudinaiheuttajat ja muut ympäristötekijät) voivat järkyttää vallitsevaa tasapainoa ja siten vaikuttaa suoliston läpäisevyyteen, mikrobiston koostumukseen sekä immuunijärjestelmään. Perifeerinen inflammaatio voi aktivoida keskushermoston immuunijärjestelmää tulehduksenvälittäjäaineiden välityksellä (2929 Pajares M, A IR, Manda G, Bosca L, Cuadrado A. Inflammation in Parkinson's disease: Mechanisms and therapeutic implications. Cells 2020;9(7).). Suoliston mikrobien ja patogeenien solurakenteet sekä aineenvaihduntatuotteet, kuten lyhytketjuiset rasvahapot, lipopolysakkaridit ja muut patogeenitoistokuviot voivat myös läpäistä veri-aivoesteen ja siten vaikuttaa keskushermoston immuunijärjestelmään.
Suolisto-oireilla on merkittävä vaikutus Parkinson-potilaiden elämänlaatuun.
Parkinson-potilailla on todettu lisääntynyttä suoliston läpäisevyyttä, inflammaatiota ja muutoksia suoliston mikrobiston koostumuksessa (3030 Aho VTE, Houser MC, Pereira PAB ym. Relationships of gut microbiota, short-chain fatty acids, inflammation, and the gut barrier in Parkinson's disease. Mol Neurodegener 2021;16:6.). Jälkimmäisellä on todettu yhteyksiä taudin etenemiseen ja suolisto-oireisiin (3131 Aho VTE, Pereira PAB, Voutilainen S ym. Gut microbiota in Parkinson's disease: Temporal stability and relations to disease progression. EBioMedicine 2019;44:691–707.,3232 Mertsalmi TH, Aho VTE, Pereira PAB ym. More than constipation - bowel symptoms in Parkinson's disease and their connection to gut microbiota. Eur J Neurol 2017;24:1375–83.). Löydökset eri aineistoista ovat kuitenkin olleet vaihtelevia, mitä osittain selittävät metodologiset, maantieteelliset ja kulttuuriset erot.
Tuoreessa, 10 mikrobistotutkimuksen aineistot yhdistävässä meta-analyysissä Lactobacillus-, Akkermansia- ja Bifidobacterium-sukujen suhteelliset osuudet olivat lisääntyneet Parkinson-potilailla, kun taas Lachnospiraceae-heimon ja Faecalibacterium-suvun suhteelliset osuudet olivat vähentyneet (3333 Romano S, Savva GM, Bedarf JR, Charles IG, Hildebrand F, Narbad A. Meta-analysis of the Parkinson's disease gut microbiome suggests alterations linked to intestinal inflammation. NPJ Parkinsons Dis 2021;7:27.). Monet Lachnospiraceae-heimoon kuuluvista bakteereista tuottavat lyhytketjuista rasvahappoa butyraattia, joka on tärkeä suoliston epiteelisolujen ravintolähde. Parkinson-potilailla on muutenkin todettu pienentyneitä lyhytketjuisten rasvahappojen pitoisuuksia, ja tällä ajatellaan olevan ehkä merkitystä taudin patogeneesissä (3030 Aho VTE, Houser MC, Pereira PAB ym. Relationships of gut microbiota, short-chain fatty acids, inflammation, and the gut barrier in Parkinson's disease. Mol Neurodegener 2021;16:6.). Esimerkiksi pienentyneiden butyraattitasojen on todettu olevan yhteydessä leukosyyttien epigeneettiseen säätelyyn Parkinson-potilailla (3434 Xie A, Ensink E, Li P ym. Butyrate and related epigenetic changes link Parkinson’s disease to inflammatory bowel disease and depressive symptoms. Mov Disord 2022, painossa. doi: 10.1002/mds.29128).
Aiemman antibioottialtistuksen, erityisesti 10–15 vuotta aiemmin tapahtuneen, on todettu olevan yhteydessä lisääntyneeseen Parkinsonin taudin riskiin (3535 Mertsalmi TH, Pekkonen E, Scheperjans F. Antibiotic exposure and risk of Parkinson's disease in Finland: A nationwide case-control study. Mov Disord 2020;35:431–42.). Pitkä viive altistuksen ja taudin puhkeamisen välillä sopii taudin syntymähypoteesiin. Selvin yhteys todettiin laajakirjoisiin ja antianaerobisiin antibiootteihin, erityisesti makrolidi- ja linkosamidiryhmän lääkkeisiin, joilla on pitkäkestoinen vaikutus suoliston mikrobiston koostumukseen (3636 Jernberg C, Lofmark S, Edlund C, Jansson JK. Long-term impacts of antibiotic exposure on the human intestinal microbiota. Microbiology 2010;156:3216–23.). Mikrobiston muutosten kausaalisesta vaikutuksesta taudin patogeneesiin ei kuitenkaan ole toistaiseksi osoitusta. On myös epäselvää, missä määrin mikrobiston muutokset ja niiden korrelaatio oireisiin selittyvät tautiin liittyvillä suoliston fysiologisilla muutoksilla, kuten hidastuneella motiliteetilla (3333 Romano S, Savva GM, Bedarf JR, Charles IG, Hildebrand F, Narbad A. Meta-analysis of the Parkinson's disease gut microbiome suggests alterations linked to intestinal inflammation. NPJ Parkinsons Dis 2021;7:27.).
Mikrobisto-suoli-aivoakseli hoidon kohteena?
On mahdollista, että Parkinsonin taudin etenemiseen ja oireisiin voitaisiin vaikuttaa mikrobisto-suoli-aivoakselin välityksellä. Esimerkiksi ohutsuolen hidastuneeseen motiliteettiin mahdollisesti liittyvällä bakteeriston liikakasvulla (small intestinal bacterial overgrowth, SIBO) saattaa olla merkitystä suolisto-oireiden sekä levodopan imeytymisen kannalta.
Mikrobisto voisi vaikuttaa levodopan metaboliaan esimerkiksi tiettyjen bakteerikantojen tuottaman tyrosiinidekarboksylaasin välityksellä (3737 van Kessel SP, Auvinen P, Scheperjans F, El Aidy S. Gut bacterial tyrosine decarboxylase associates with clinical variables in a longitudinal cohort study of Parkinsons disease. NPJ Parkinsons Dis 2021;7:115.). Pienessä aineistossa ohutsuolen bakteeriston liikakasvun hoito rifaksimiinilla vähensi suolisto-oireita ja motorisia tilanvaihteluja. Kroonista gastriittia aiheuttavan helikobakteerin kantajuus on yhteydessä vaikeampiin motorisiin oireisiin ja huonompaan lääkevasteeseen, mutta häätöhoidon hyödystä ei ole vahvaa näyttöä (3838 Tan AH, Lim SY, Mahadeva S ym. Helicobacter pylori eradication in Parkinson's disease: A randomized placebo-controlled trial. Mov Disord 2020;35:2250–60.).
Eläinkokeista on saatu viitteitä, että ulosteensiirrolla voitaisiin vaikuttaa motorisiin oireisiin ja jopa neuroinflammaatioon (3939 Sun MF, Zhu YL, Zhou ZL ym. Neuroprotective effects of fecal microbiota transplantation on MPTP-induced Parkinson's disease mice: Gut microbiota, glial reaction and TLR4/TNF-alpha signaling pathway. Brain Behav Immun 2018;70:48–60.). Ensimmäiset kliiniset kokeet ulosteensiirron vaikutuksista oireisiin ovat käynnissä. Ravinnon proteiineilla on tunnetusti vaikutusta levodopan imeytymiseen, mutta ruokavaliolla voi olla muutakin merkitystä hoidon kannalta. Eräässä satunnaistetussa vertailututkimuksessa fermentoitu maitovalmiste, joka sisälsi probiootteja ja prebioottisia kuituja, lievitti Parkinson-potilaiden ummetusta (4040 Barichella M, Pacchetti C, Bolliri C ym. Probiotics and prebiotic fiber for constipation associated with Parkinson disease: An RCT. Neurology 2016;87:1274–80.).
Lopuksi
Suolisto-oireilla on merkittävä vaikutus Parkinson-potilaiden elämänlaatuun, ja niitä tulisi hoitaa aktiivisesti. Suolistolla ja sen mikrobistolla vaikuttaa olevan merkitystä taudin muidenkin oireiden ja patogeneesin taustalla ainakin osalla potilaista. Taudin alaryhmien parempi tuntemus helpottaisi näiden yhteyksien ymmärtämistä ja voisi tulevaisuudessa mahdollistaa tautiprosessia muovaavien mikrobisto-suoli-aivoakseliin kohdistuvien hoitomuotojen kehittämisen.
Tuomas Mertsalmi
LT, erikoistuva lääkäri
Filip Scheperjans
dosentti, neurologian erikoislääkäri
Hus, Hyks Aivokeskus, neurologian klinikka ja Helsingin yliopisto, kliinisten neurotieteiden yksikkö
Kirjoitus on julkaistu aiemmin Lääkärilehden verkkosivuilla.